Ultimo Aggiornamento 17 Maggio 2011
Il termine angiogensi fu coniato per la prima volta nel 1935, per descrivere la organizzazione di nuovi vasi nella placenta. Però già dal 1909 era stato osservato il processo di formazione di nuove strutture vascolari che si presentavano inizialmente come capillari attorno a cui altre cellule vascolari e componenti della matrice si organizzavano.
Oggi si distinguono due processi in cui l’organismo costruisce nuovi vasi: la vasculogenesi, che avviene dirante la embriogenesi ed è la differenziazione in situ di precursoti derivanti dal mesoderma in cellule endoteliali; e la angiogenesi vera e propria che avviene nell’individuo adulto ed è la formazione di nuovi vasi a partire da quelli preesistenti.
Come processo fisiologico, in aggiunta al suo ruolo durante lo sviluppo, l’angiogenesi accompagna la formazione del corpus luteus, la riparazione di ferite e contribuisce ad aumentare la perfusione di organi ischemici.
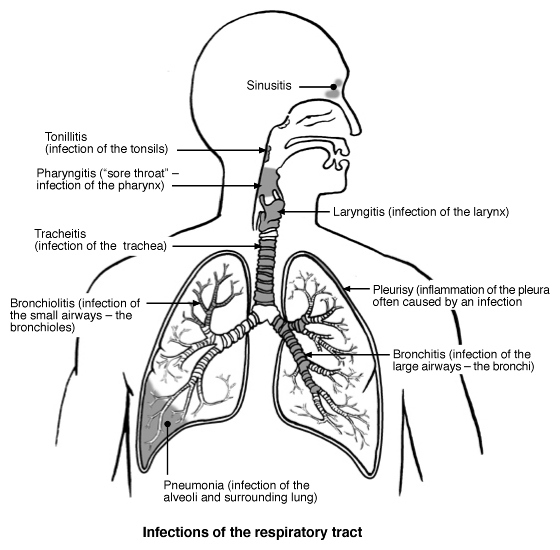
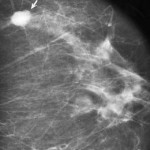
Molte volte però la angiogenesi è causa di patologia come nella retinopatia diabetica o nelle malattie reumatiche, o contribuisce a fenomeni patologici come la crescita di tumori solidi. Conosciamo ancora poco dei meccanismo di regolazione della crescita dell’endotelio. E’ importante considerare che queste cellule sono, in condizioni nomali, particolarmente statiche. L loro vita media calcolata in diverse maniere è di circa 27 anni.
Formazione
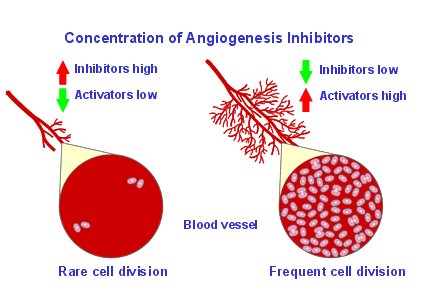
Tuttavia durante la formazione di nuove strutture vascolari, la divisione cellulare diventa estremamente frequente e le cellule presentano una vita media molto più corta, di circa 10 giorni. Il processo angiogenetico segue diverse fasi. Inizialmente alcune cellule endoteliali organizzare in capillari tendono ad invadere la matrice circostante estrudendo processi citiplasmatici in direzione dello stimolo angiogenetico. La morfologia che le cellule adottano, assomiglia molto a quella dei leucociti durante la migrazione verso uno stimolo chemiotattico.
In seguito, le cellule endoteliali migrano all’interno dello stroma che le circonda e formano un primo rudimento di capillare. Questo rudimento matura e si forma il lume del vaso attraverso l’incurvarsi delle cellule endoteliali, in seguito diversi rudimenti si fondono e si forma una fine rete vascolare dove comincia a scorrere il sangue.
Questo processo può essere schematizzato in tre fasi fondamentali:
- Iniziale degradazione enzimatica della matrice da parte delle cellule
- La loro migrazione dentro di essa
- La proliferazione delle cellule endoteliali
Questa analisi ha portato allo sviluppo di test biologici per studiare separatamente questi fenomeni. Con questi strumenti sperimentali è stato possibile caratterizzare dagli inizi degli anni 80 una serie di sostanze in grado d influenzare queste attività.
Queste sostanze agiscono come fattori di crescita per l’endotelio e il più delle volte inducono la formazione di nuovi vasi in modelli sperimentali in vivo.
Inoltre va considerato che le sostanze che inducono la crescita dell’endotelio sono per lo più non specifiche, sono in grado cioè di stimolare la proliferazione e la migrazione anche di altre cellule. Questo fa pensare che il processo angiogenetico non sia un fenomeno indipendente, ma che si accompagni alla attivazione e proliferazione dei tessuti circostanti.
Fattori angiogenetici
La famiglia meglio caratterizzata dei mitogeni endoteliali è quella degli FGF o heparin binding growth factors. FGF è un termine usato inizialmente per descrivere un mitogeno dei fibroblasti parzialmente purificato dal cervello bovino.
In seguito si vide che questo fattore era mitogenico per molti tipi cellulari di origine mesoteliale incluse le cellule endoteliali. Questa osservazione fu ulteriormente convalidata dal fatto che FGF parzialmente purificato era angiogenico in una serie di modelli sperimentati in vivo.
Un contributo fondamentale alla caratterizzazione di questi fattori che legato alla osservazione che hanno tutti un’affinità molto alta per la eparina. Questo ha permesso di purificarli facilmente utilizzando colonne di affinità di eparina e di arrivare a definire la loro struttura molecolare .
Le analisi della struttura e della omologia degli FGF che presentano attività di stimolo per l’endotelio ha portato alla loro suddivisione in due gruppi principali i cui prototipi sono l’FGF acidico e l’FGF basico che tra loro presentano una omologia sequenza di circa 50%. Molti membri di queste due classi però sono semplicemente delle varianti a peso molecolare diverso dei fattori prototipo.
La prima classe costituita da polipeptidi anionici con punto isoelettrico da 5 a 7. Questi fattori sono stati estratti perlopiù da tessuti di origine nervosa come cervello retina e occhio.
La seconda classe costituita da polipeptidi cationici con punto isoelettrico tra 8 e 10. Questa categoria dei fattori è particolarmente ubiquitaria. L’FGF basico è stato estratto dal cervello, occhio, corpo luteo, osso, ghiande adrenergiche, reni, placenta, macrofagi, cellule di epatoma e altri tessuti.
Risposta biologica
La risposta biologica delle cellule all’FGF è mediata attraverso recettori ad alta affinità dotati di un’attività tirosin-chinasica intrinseca. L’alta affinità dell’FGF tendere accumularsi nella matrice cellulare e sulla membrana cellulare legandosi agli eparan solfati che sono qui concentrati. Questo legame protegge l’FGF dalla denaturazione ed alla inattivazione enzimatica.
Accanto questo gli eparani sono indispensabili per gli effetti indotti dall’FGF. Solo l’FGF che si è legato in precedenza agli eparani della membrana cellulare è in grado poi di legare i recettori ad alta affinità responsabili dell’effetto di induzione della crescita. Restano alcuni punti oscuri nella maniera in cui le cellule liberano all’esterno FGF. Queste molecole mancano infatti della sequenza tipica delle proteine che vengono secrete. Questo può suggerire che questi fattori di crescita vengano liberati solo in certe circostanze come ad esempio in caso di danno cellulare.
Questo aspetto come pure la modulazione di affinità e numero di recettori specifici sulle cellule potrebbe essere la maniera cui l’attività dell’FGF viene modulata. Tutte quelle classi di FGF stimolano in vitro le attività dell’endotelio necessarie alla angiogenesi menzionate in precedenza: proteolisi della matrice, chemiotassi e mitogenesi. Inoltre, gli FGF sono angiogenici in diversi modelli speriementali in vivo.
Vista la complessità dell’argomento il resto verrà trattato in un secondo articolo sulla angiogenesi.